Missions pour les Big Pharma et la FDA : aucune contre-indication selon McKinsey
Un peu plus d’un an après avoir conclu un accord de 573,9 millions de dollars pour ses liens avec les fabricants d’opioïdes, accusés d’avoir contribué à l’épidémie d’overdoses que rencontrent les États-Unis depuis des années – 100 000 morts en 2021 –, McKinsey est aujourd’hui suspecté de conflit d’intérêts.
- Opioïdes : McKinsey pénalement responsable pour ses conseils et privé de certaines missions pharma
- Opioïdes : une addition vertigineuse de 1,5 milliard de dollars pour McKinsey aux USA
- Perquisition au ministère de la Santé dans le cadre de soupçons de « favoritisme » sur des marchés de conseil
- Scandale des opioïdes : l’addition s’alourdit de 78 M$ pour McKinsey
- Overdoses aux antalgiques : nouvelle amende historique pour McKinsey aux USA
- McKinsey au chevet du géant de la santé grand public
- Au Canada, l’ancien patron de McKinsey sous le feu des questions parlementaires
- Aux États-Unis, plus difficile de servir public et privé en même temps

Au moins 22 consultants de la firme auraient en effet conseillé à la fois des labos pharmaceutiques fabriquant ces puissants antalgiques, et la Food and Drug Administration (FDA), organisme public qui délivre les autorisations de mise sur le marché des médicaments aux États-Unis… et lutte contre les abus d’opioïdes. Entendu par le Congrès américain ce mercredi 27 avril, le PDG monde, Bob Sternfels, a nié les faits reprochés.
C’est un rapport accablant que la commission de suivi et de la réforme de la Chambre des représentants, principale commission d’enquête de la chambre basse du Parlement aux États-Unis, a publié le 13 avril 2022, suite à l’ouverture d’une enquête en novembre dernier. Au total, 53 pages s’appuyant sur des centaines de milliers de documents – dont 350 000 pages de documents internes fournies par McKinsey – portant sur la période 2007-2019 et pointant plusieurs conflits d’intérêts de la part de la firme dans l’affaire des opioïdes.
Au moins 22 consultants dans le viseur
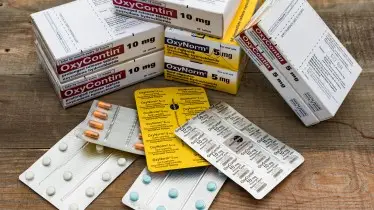
L’implication de McKinsey n’est pas nouvelle. Début 2019, le public a appris que le cabinet avait conseillé plusieurs fabricants d’opioïdes de 2004 à 2019 – dont Purdue Pharma, Johnson & Johnson, Endo Pharmaceuticals et Mallinckrodt – dans leurs stratégies marketing et commerciales. L’objectif : les aider à booster les ventes de ces antalgiques accusés d’avoir rendu accros des centaines de milliers d’Américains.
à lire aussi

Aux États-Unis, dans le scandale des fabricants d'opioïdes, ces antalgiques accusés d'avoir rendu des centaines de milliers d'Américains dépendants à la drogue et auxquels 450 000 décès sont attribués depuis 1999, on connaissait depuis début 2019 le rôle de McKinsey auprès d'un de ces fabricants, Purdue Pharma, le labo détenu par la richissime famille Sackler (relire notre article) qui produit l'un des médicaments mis en cause, l'OxyContin. McKinsey aurait conseillé le laboratoire sur la manière de fortement augmenter ses ventes d'opioïdes, dans un contexte où les mesures de santé publique visant à en réduire la consommation de ces opioïdes se démultipliaient.
Bien que jamais poursuivi, McKinsey a conclu un accord à 573,9 millions de dollars avec 47 États américains en réparation du rôle qu’il a joué dans cette crise (relire notre article), s’évitant ainsi un procès. En revanche, il n’est toujours pas sorti d’affaire. Cette fois, le cabinet est accusé de conflit d’intérêts.
Le point culminant des accusations à l’encontre de la firme : ses missions cumulées pour aider les fabricants d’opioïdes à augmenter leurs ventes d’un côté, et pour la Food and Drug Administration (FDA) de l’autre.
Depuis 2007, au moins 22 consultants McKinsey auraient en effet travaillé pour ces labos et en simultané pour l’autorité en charge d’autoriser ou non la mise sur le marché de médicaments aux États-Unis, qui lutte également contre l’usage abusif des opioïdes. Des substances, pour rappel, responsables de plus de 500 000 morts par overdose depuis le début de ce qu’on appelle aujourd’hui « l’épidémie des opioïdes », à la fin des années 1990.
Parmi eux, le Dr Jeff Smith, senior partner McKinsey, qui a accepté une mission plutôt sensible en décembre 2017 pour Purdue Pharma, le fabricant du désormais célèbre OxyContin, condamné à plusieurs reprises. Le senior partner devait aider l’entreprise détenue par la très secrète famille Sackler à maximiser le potentiel de marché d’un nouvel opioïde et d’un autre médicament qui serait prochainement déposé à la FDA. Problème : le même partner était en même temps en charge d’une mission à 2,7 millions de dollars pour aider à moderniser la FDA.
D’autres exemples moins récents ont été mis sur la table par la commission. Comme ces quatre consultants (au moins) en charge d’un contrat à 1,8 million de dollars pour aider la FDA à améliorer la sécurité des médicaments, qui travaillaient en parallèle pour Purdue Pharma. « L’un des projets consistait à écrire des scripts pour Purdue, qui seraient ensuite utilisés lors de réunions avec la FDA pour parler de la sécurité de l’OxyContin pédiatrique », note le rapport d’enquête.
140 millions de dollars de la FDA
Durant tout ce temps, McKinsey n’aurait pas informé la FDA de l’existence de ses autres clients pour le moins gênants. D’après la commission, la firme aurait même profité de ce jeu sur deux tableaux pour conseiller les fabricants d’opioïdes sur la façon d’éviter des réglementations plus strictes.
Il est notamment fait mention d’un échange datant de 2014 entre un partner et le PDG de Purdue Pharma dans lequel sont mis en avant les liens de McKinsey avec les régulateurs publics, « y compris la FDA que nous accompagnons depuis plus de cinq ans ». Une semaine plus tard, McKinsey a confirmé plusieurs engagements avec Purdue, y compris un projet piloté par « un partner qui a fréquemment consulté la FDA pour préparer Purdue à une réunion du comité consultatif sur l’un de ses opioïdes ».
Des consultants en lien avec Purdue Pharma sont par ailleurs suspectés d’avoir voulu influencer directement des responsables de la santé publique sous l’administration Trump, au sujet de l’épidémie d’opioïdes. En particulier Alex Azar, secrétaire en charge de la Santé et des Services sociaux de 2018 à 2021. Ils lui auraient rédigé une note en 2018 « comprenant certaines recommandations alignées sur les intérêts des clients privés de McKinsey » sur la question des opioïdes.
« Dans les coulisses, les consultants de McKinsey ont tiré avantage de leurs relations fédérales pour obtenir encore plus d’affaires dans le secteur privé et ont tenté d’influencer les principaux responsables de la santé publique au nom de clients comme Purdue Pharma », a déclaré Carolyn Maloney, membre de la Chambre des représentants et présidente de la commission de suivi et de la réforme.
Le tout en engrangeant au passage une importante somme d’argent public, comme l’ont souligné les membres de la Chambre des représentants : 140 millions de dollars pour ses missions avec la FDA. Sur la même période, la firme a gagné 86 millions de dollars grâce à ses contrats avec Purdue Pharma.
Côté McKinsey, on nie en bloc
Malgré toutes ces accusations, la position de McKinsey est restée la même : « il n’y a pas eu de conflit d’intérêts ». Une déclaration maintenue et répétée par Bob Sternfels durant son audition face aux membres de la Chambre des représentants, mercredi 27 avril (revoir la vidéo de son audition par le congrès ). « Nous ne cachons pas avoir travaillé à la fois pour la FDA et les sociétés pharmaceutiques, a-t-il déclaré. Mais nous ne pensons pas qu’il y ait eu conflit d’intérêts étant donné que nous n’avions pas de parti pris et que les missions portaient sur des sujets différents. »
D’après ses déclarations, environ 60 % des missions réalisées pour la FDA depuis quinze ans concernaient l’amélioration des process métiers, 20 % portaient sur des problèmes organisationnels et les 20 derniers % sur l’implémentation de nouvelles technologies. Rien en lien direct avec les politiques ou décisions réglementaires concernant les opioïdes, leur mise sur le marché ou leur distribution. En d’autres termes, « le récent rapport du comité a tiré des conclusions inexactes », a assuré Bob Sternfels.
« Je suis très déçue que vous continuiez à nier », a conclu Carolyn Maloney avant d’ajourner la séance. La commission entend poursuivre ses investigations et attend de McKinsey une totale collaboration, comme s’y est engagé Bob Sternfels, qui a rappelé : « Presque tous les documents cités dans le rapport ont été fournis volontairement par McKinsey en novembre 2021, dans les deux semaines qui ont suivi la demande de la part des membres de la commission, et nous sommes restés en contact permanent avec eux pour comprendre et répondre à leurs priorités tout au long de l’enquête. »
Quelques jours avant, dans un communiqué, McKinsey avait cependant garanti vouloir « protéger fermement les informations confidentielles de [ses] clients ». Une mission devenue désormais difficile. Comme en France – où il est sous le feu médiatique depuis plus d’un an (relire notre article) –, le cabinet se retrouve à nouveau contraint d’exposer sur la place publique des informations confidentielles sur ses clients, sur ses propres terres cette fois, aux États-Unis. De quoi peser un peu sur son image (lire ici) et questionner son avenir avec le secteur public aux États-Unis, plusieurs parlementaires appelant pendant l’audience à suspendre toute commande publique au cabinet de conseil comme l’a déjà annoncé la FDA mardi, dans l’attente des conclusions de l’enquête.
Chronologie des faits
|

Un tuyau intéressant à partager ?
Vous avez une information dont le monde devrait entendre parler ? Une rumeur de fusion en cours ? Nous voulons savoir !
commentaire (0)
Soyez le premier à réagir à cette information
pharmacie - santé
 02/04/25
02/04/25L’ancienne co-leader de la practice Produits pharma et médicaux pour l’Europe, Dominique Bery, prend la tête d’Ipsen en France. Depuis son départ de McKinsey en 2017, l’ex-partner Santé avait intégré le groupe biopharmaceutique « made in France », avant tout dédié à l’oncologie (près de 75 % de son activité).
 20/01/25
20/01/25Il avait officiellement quitté McKinsey fin décembre. Jérémie Ghandour, partner depuis 11 ans, leader de la practice Operations au niveau européen, est directeur de l’exploitation (COO) chez Havea (anciennement Ponroy Santé).
 16/01/25
16/01/25Klineo, la start-up française de l’alumni d’Oliver Wyman, Thomas Peyresblanques, passe à une nouvelle phase. Cette plateforme de mise en relation de patients atteints de cancer avec des médecins proposant des essais cliniques a levé 2 millions d’euros. Et ce auprès de business angels, soutenus par BPI France.
 16/12/24
16/12/24Clap de fin dans le scandale des opioïdes : pour la première fois aux Etats-Unis, un cabinet de conseil en stratégie est reconnu pénalement responsable d’activités ayant contribué à de graves délits commis par l'un de ses clients.
 18/10/24
18/10/24Le géant du conseil s’apprêterait à conclure un accord avec les procureurs américains afin de mettre un terme aux enquêtes fédérales toujours en cours. L’impact financier pour les associés mondiaux serait une nouvelle fois significatif.
 14/10/24
14/10/24Vente d’Opella, la branche santé grand public de Sanofi qui produit notamment le Doliprane, tentative de cession – ajournée – de Biogaran par Servier… Que disent ces mouvements des conditions actuelles de la création de valeur dans l’industrie pharmaceutique ? Le regard de plusieurs associés d’Advention, CVA et Eight Advisory S&O.
 18/07/24
18/07/24Pierre Kemula, actuel CFO de CureVac, alumni de Kéa et Roland Berger, assurera la direction financière d’Agomab dès novembre prochain.
 15/07/24
15/07/24Pour pallier la démission de son directeur général, Virbac nomme l’actuel directeur des Affaires financières du groupe, Habib Ramdani, DG par intérim.
 20/06/24
20/06/24Julie Dollé, près de 11 ans de BCG à son actif, vient de quitter le cabinet de conseil en stratégie afin de lancer son entreprise. L'ex-partner spécialisée en développement durable veut créer un réseau de maisons de soins de support (non médicaux) pour les malades atteints de cancer pendant et après la maladie (les Maisons Soma).





